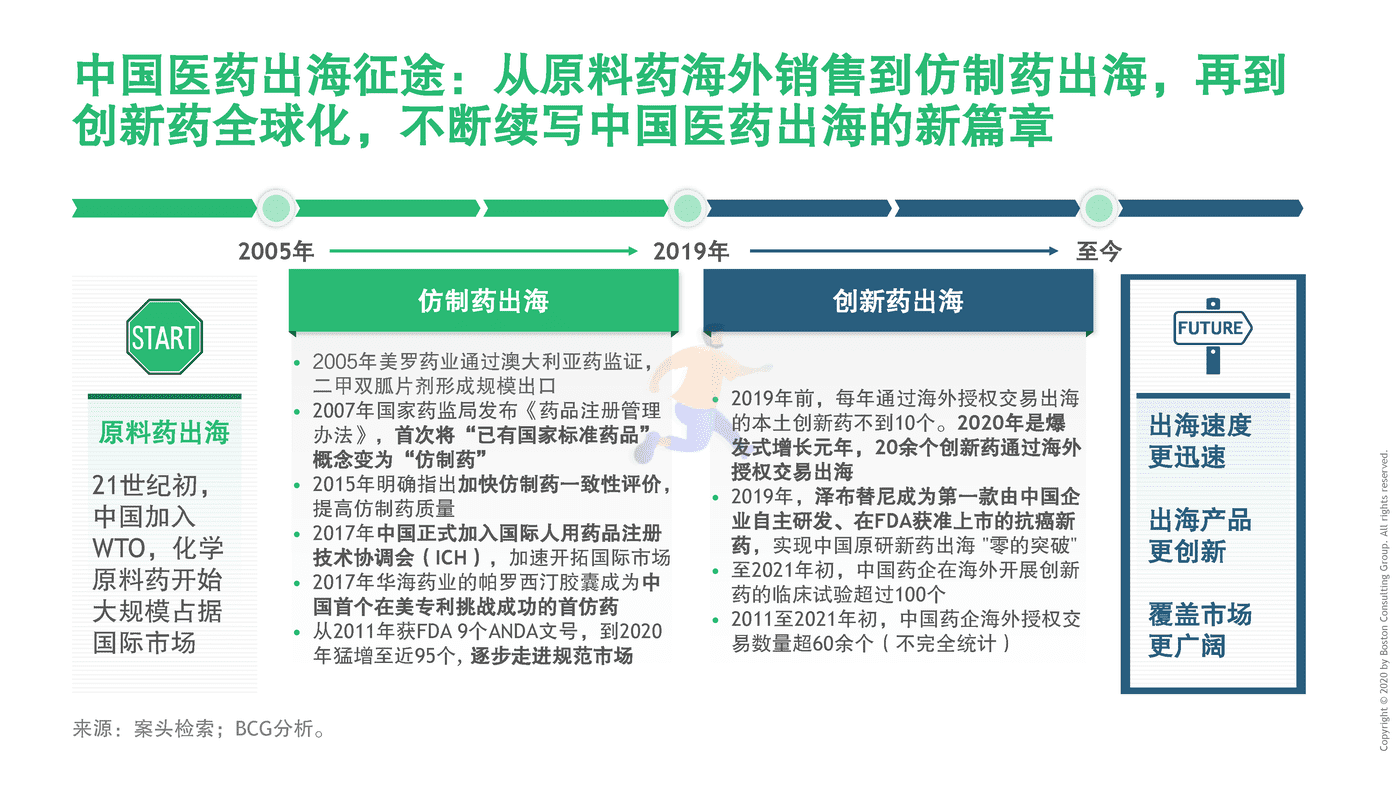
2005年美罗药业通过澳大利亚药监证,二甲双胍片剂形成规模出口
2007年国家药监局发布《药品注册管理办法》,首次将“已有国家标准药品” 概念变为“仿制药”
2015年明确指出加快仿制药一致性评价,提高仿制药质量
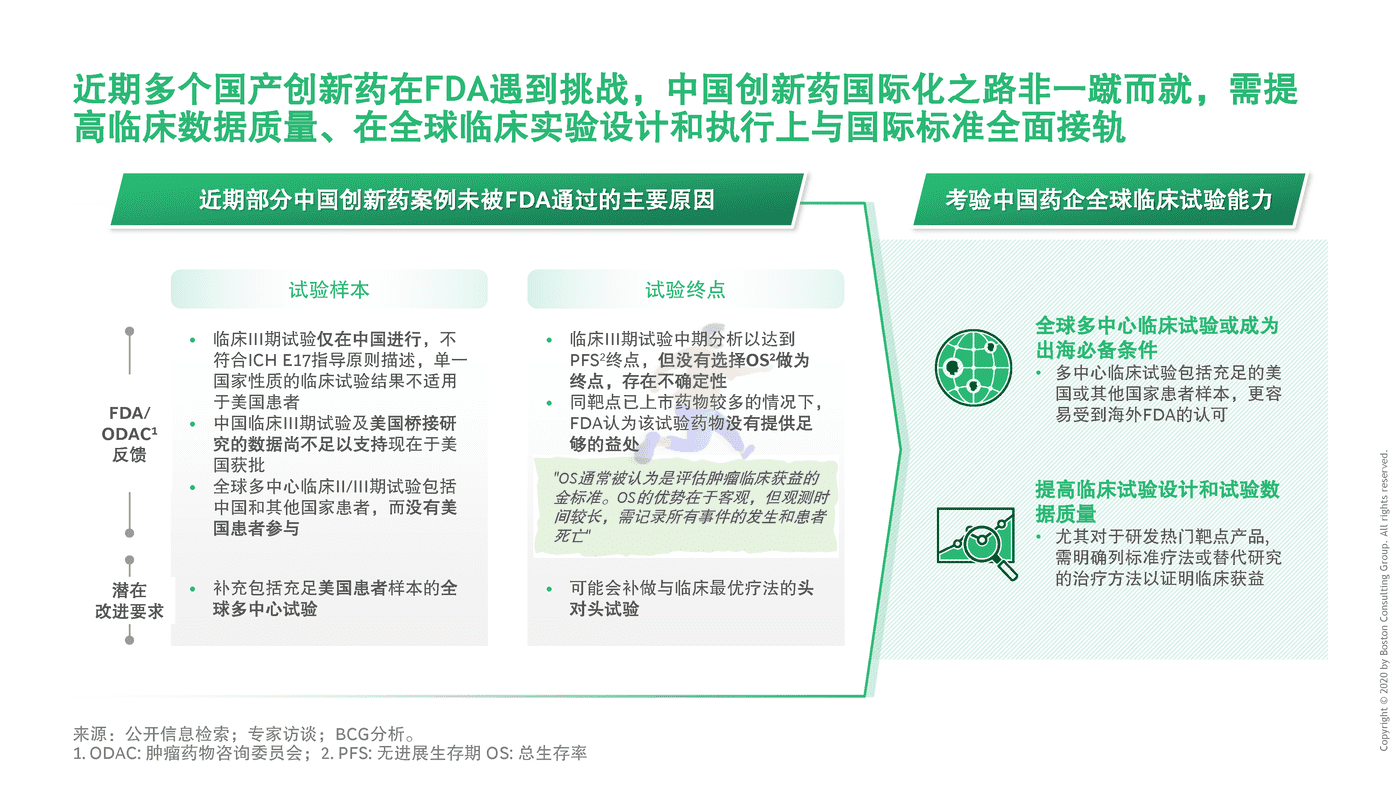
2017年中国正式加入国际人用药品注册技术协调会(ICH),加速开拓国际市场
2017年华海药业的帕罗西汀胶囊成为中国首个在美专利挑战成功的首仿药
从2011年获FDA 9个ANDA文号,到2020年猛增至近95个, 逐步走进规范市场
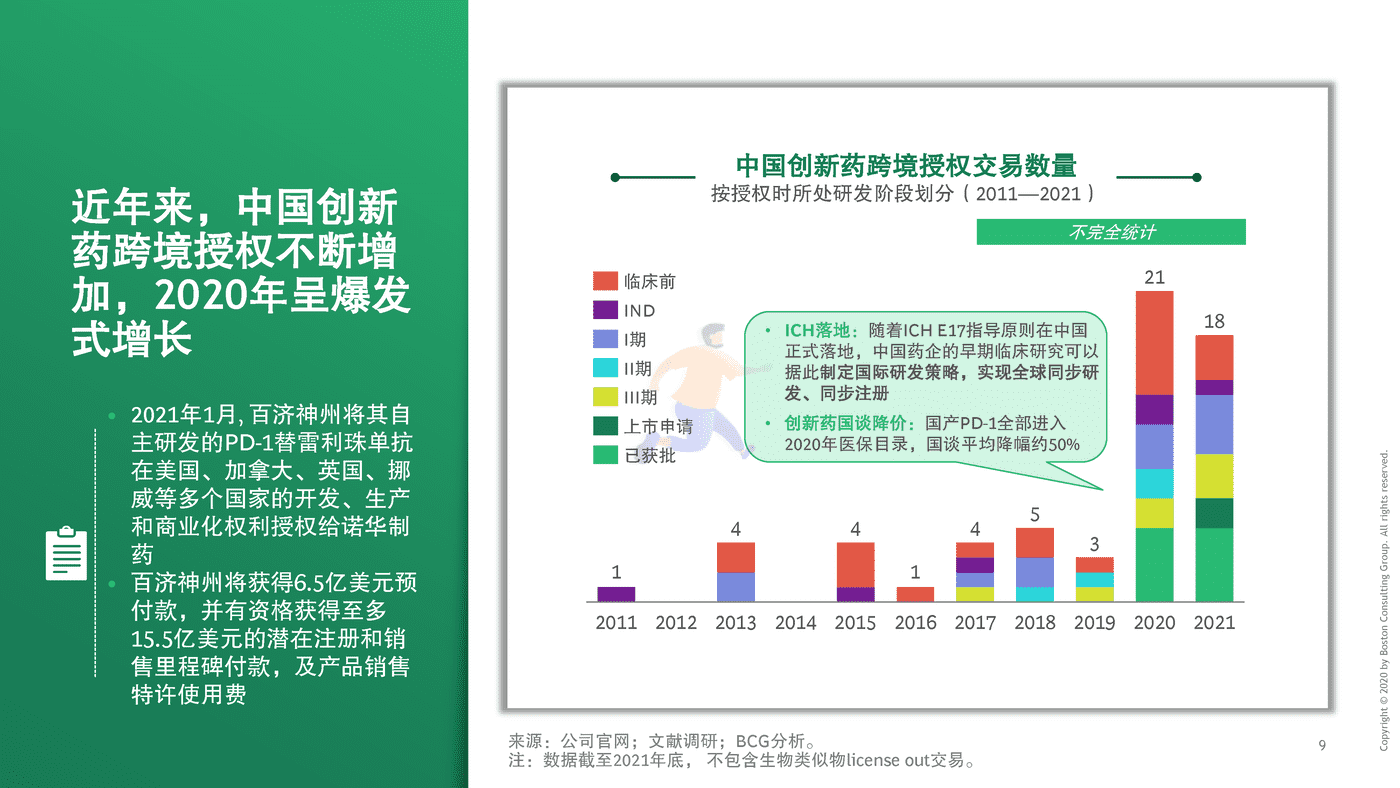
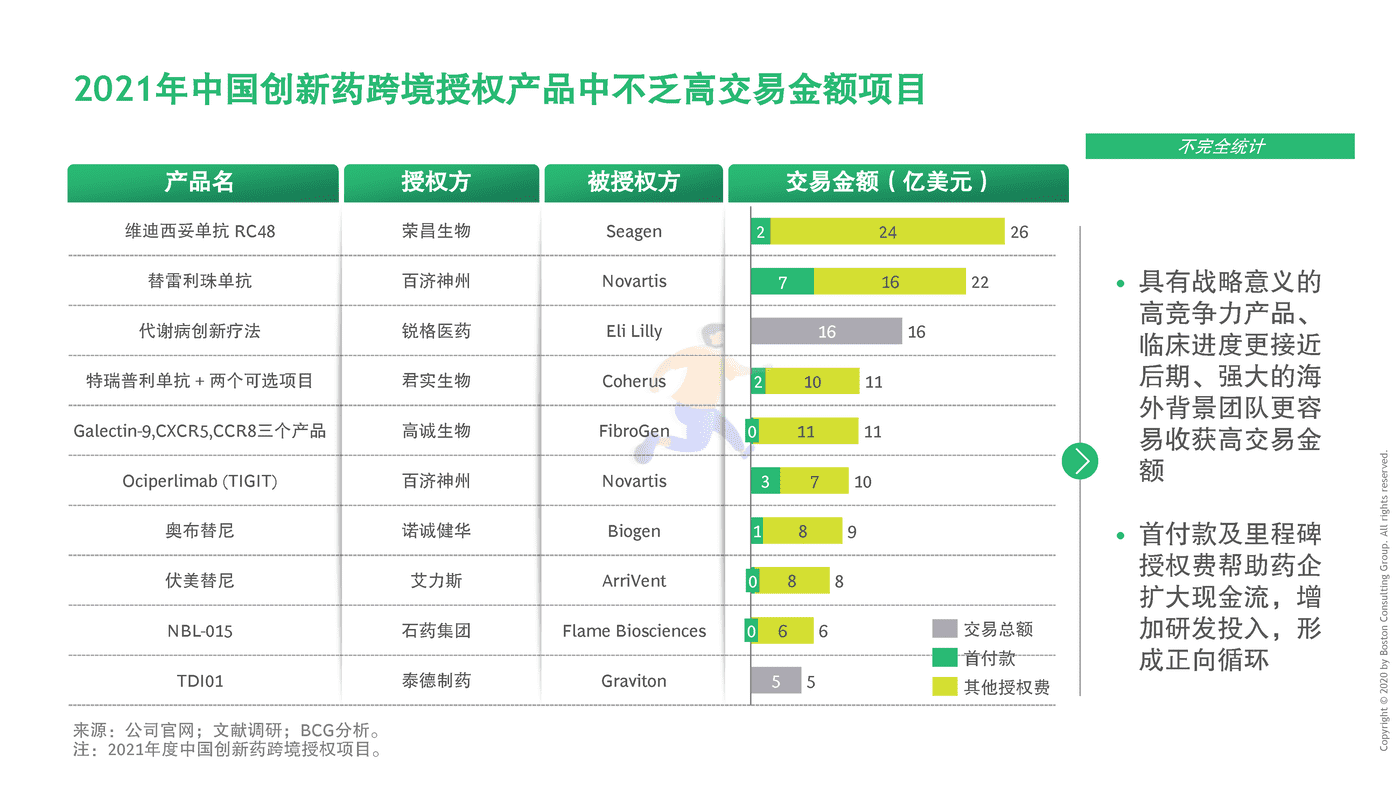
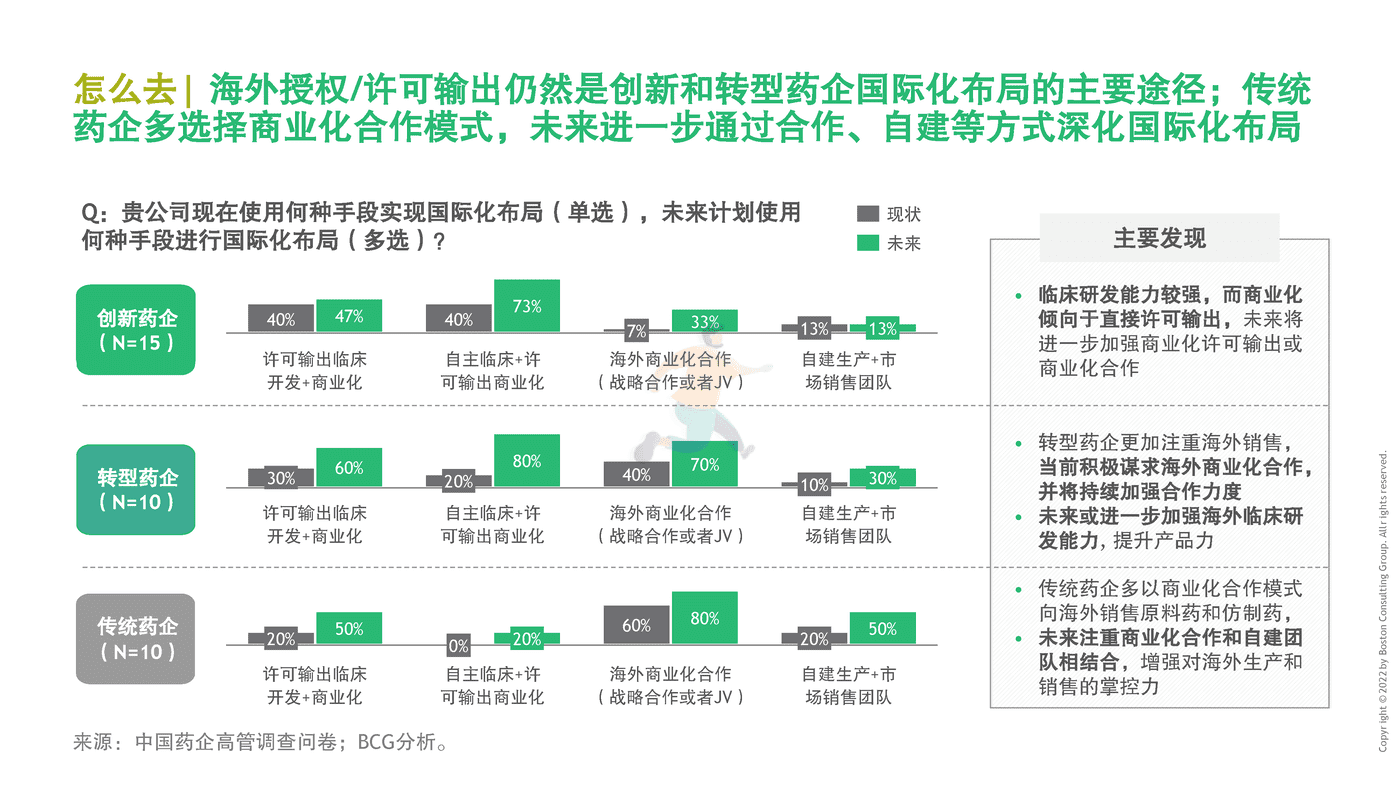
2019年前,每年通过海外授权交易出海的本土创新药不到10个。2020年是爆发式增长元年,20余个创新药通过海外授权交易出海
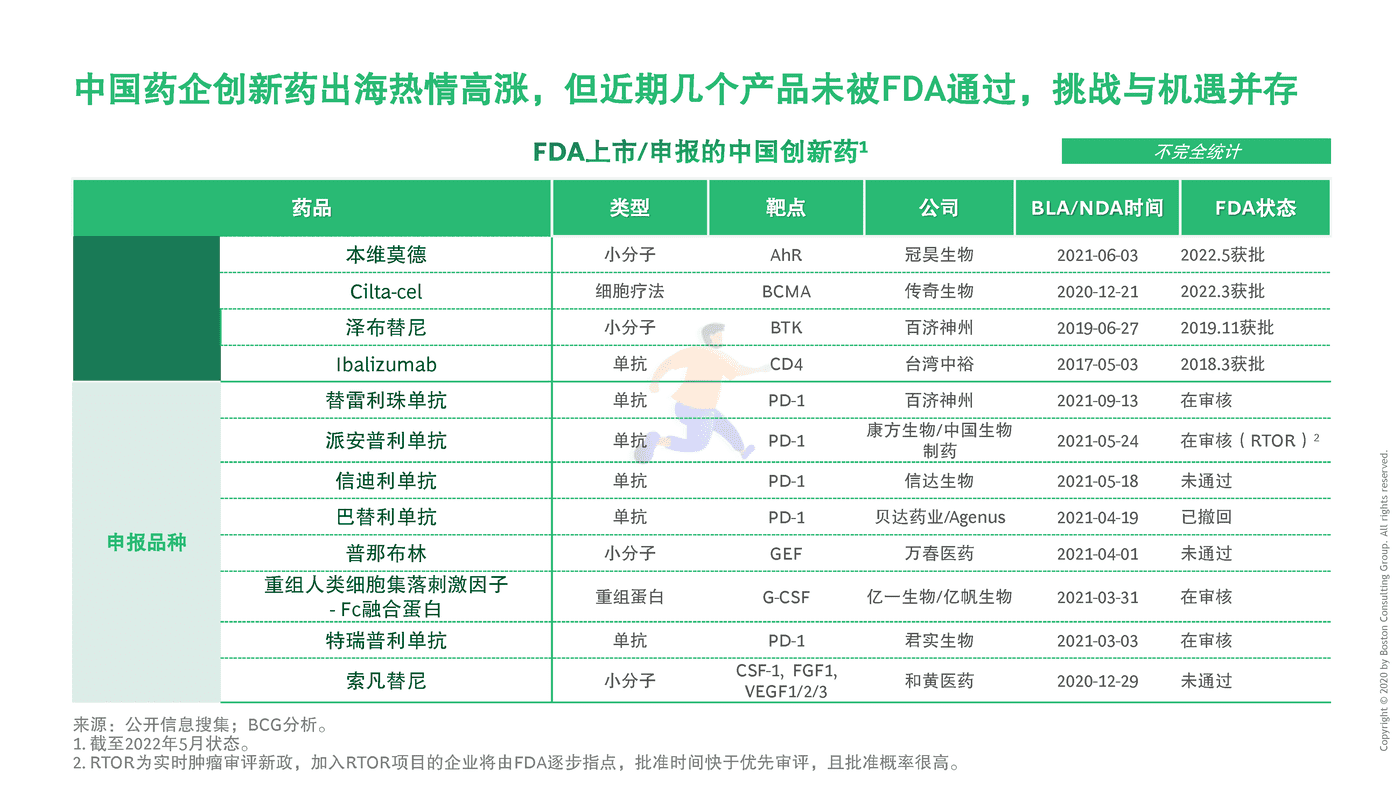
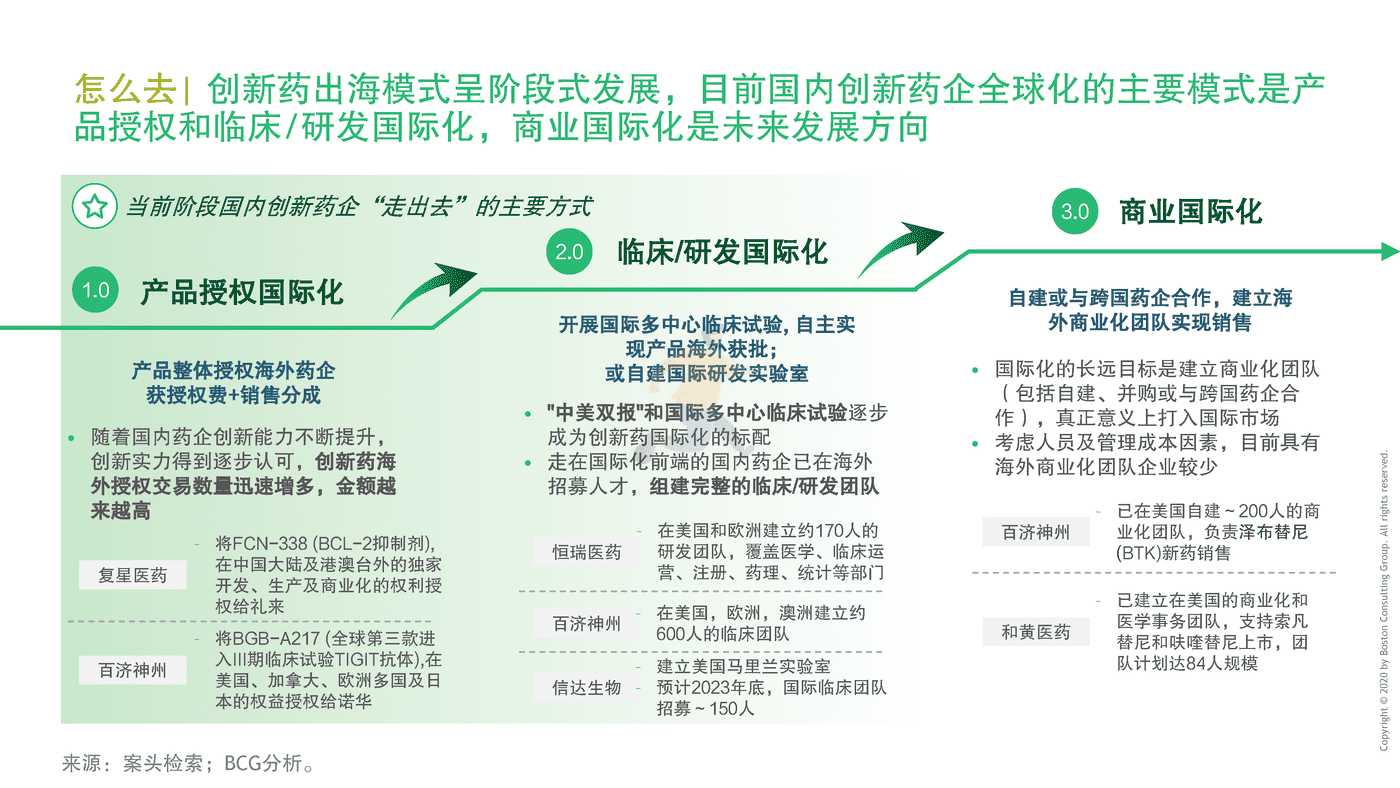
2019年,泽布替尼成为第一款由中国企业自主研发、在FDA获准上市的抗癌新药,实现中国原研新药出海 "零的突破"
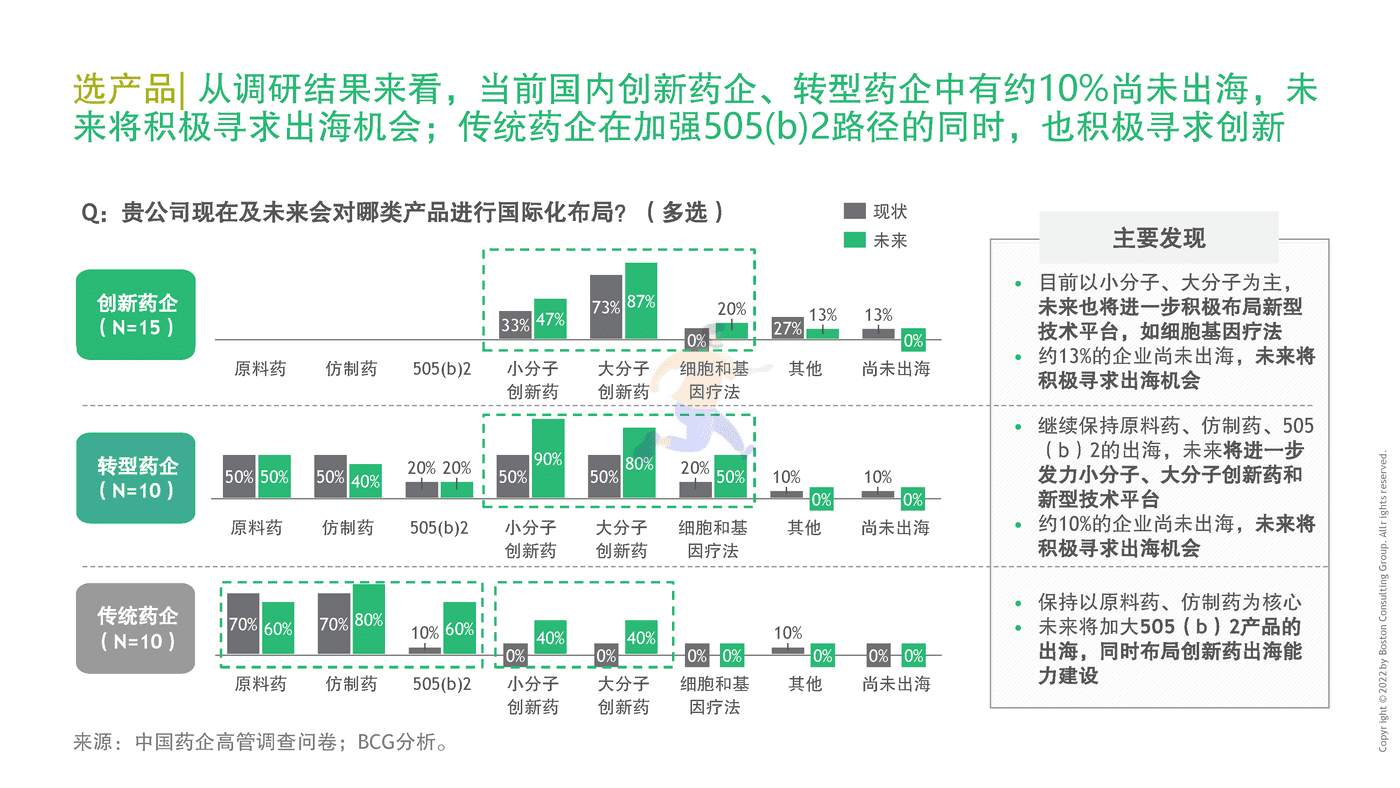
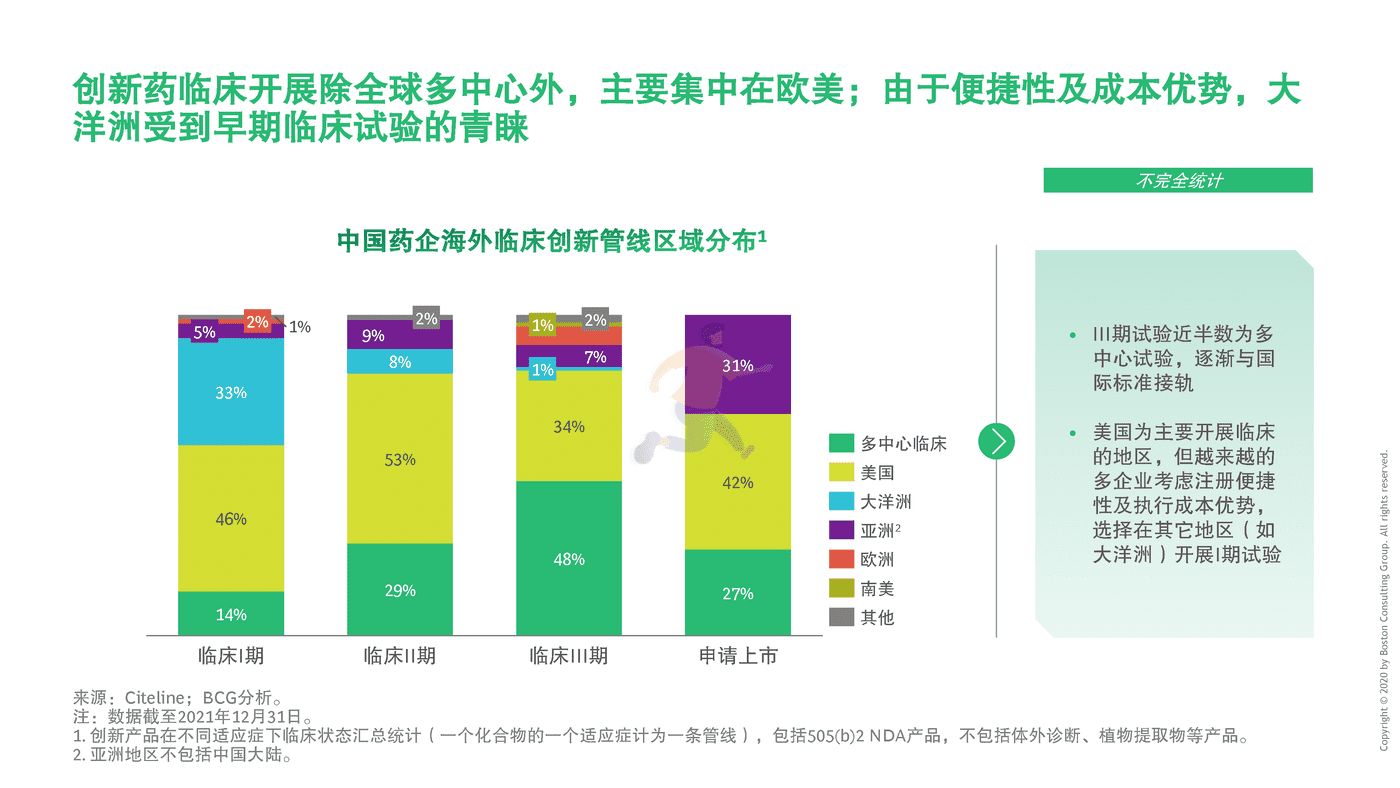
至2021年初,中国药企在海外开展创新药的临床试验超过100个
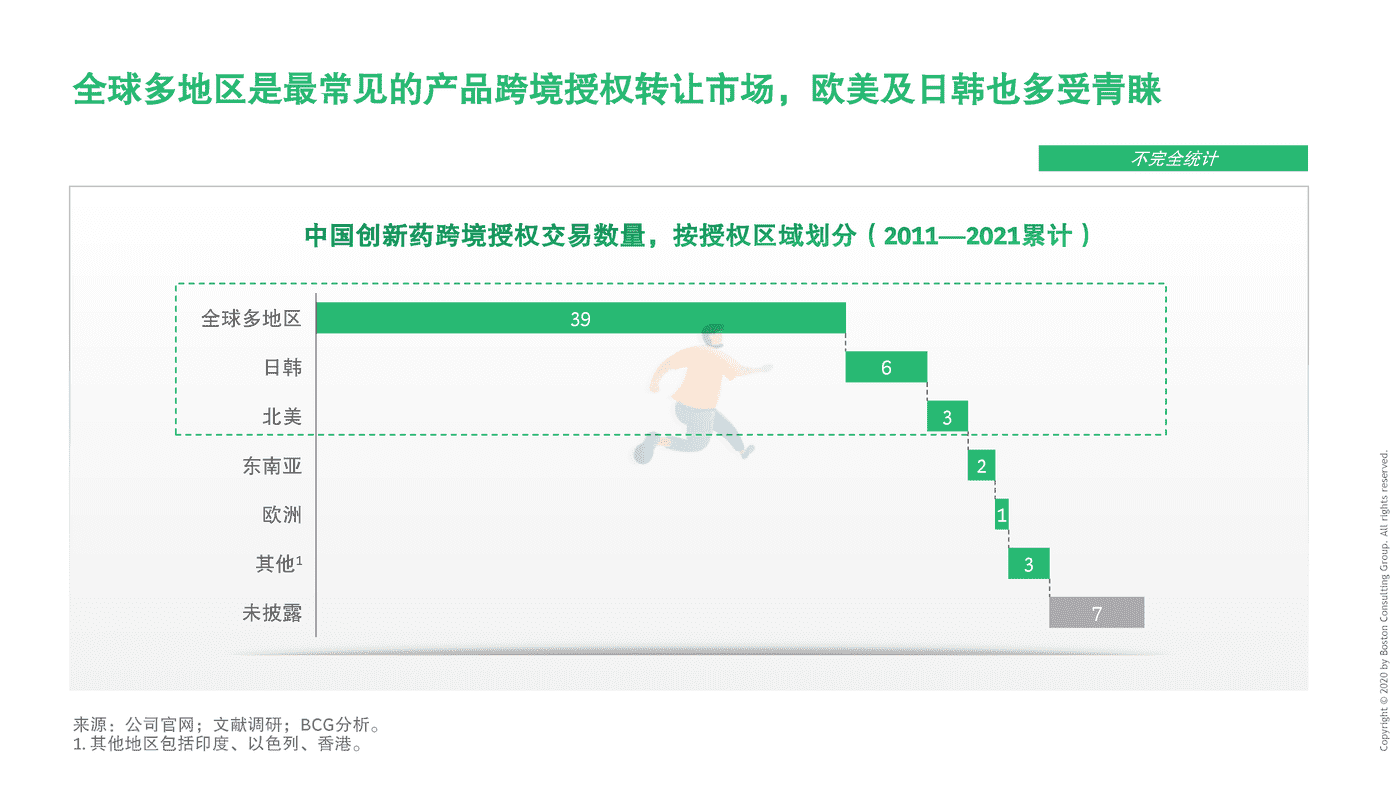
2011至2021年初,中国药企海外授权交易数量超60余个(不完全统计)
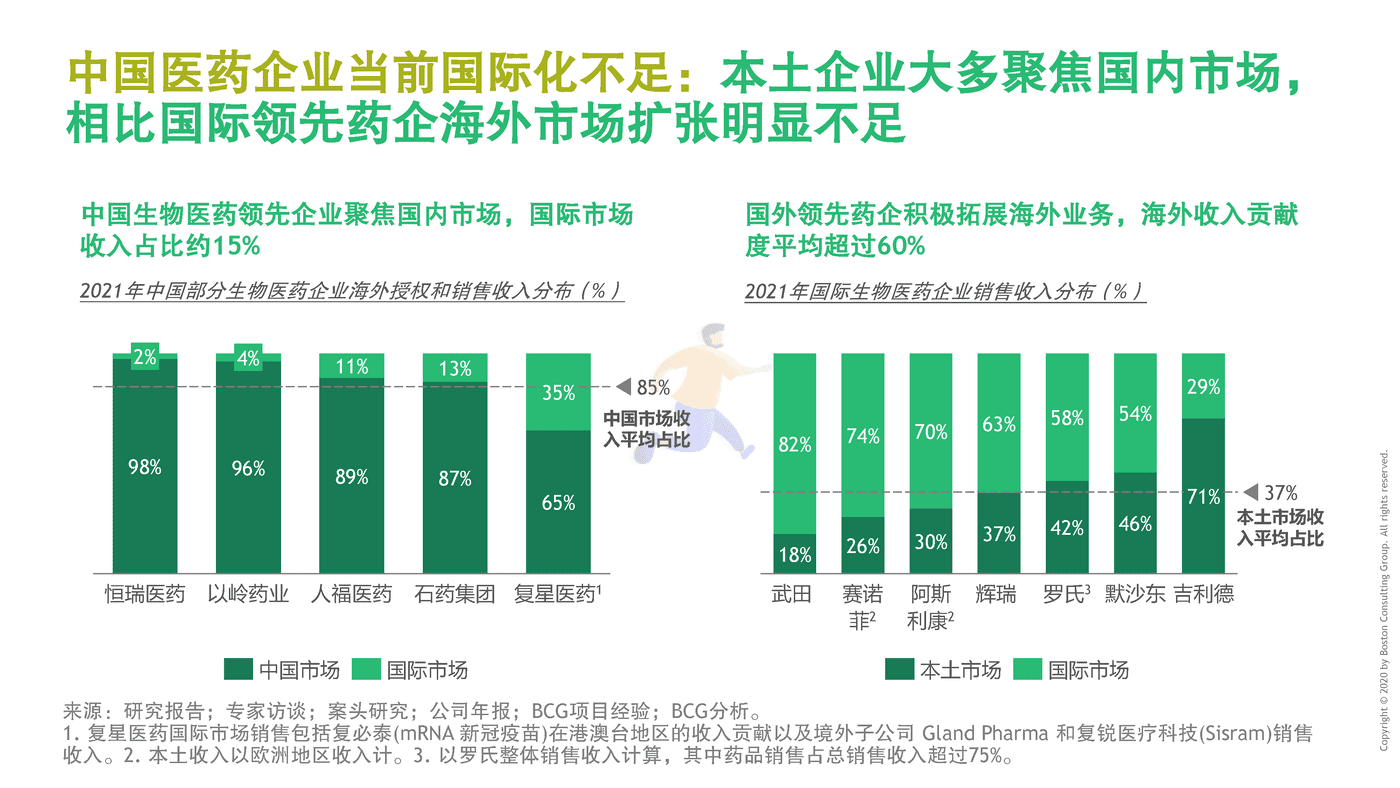
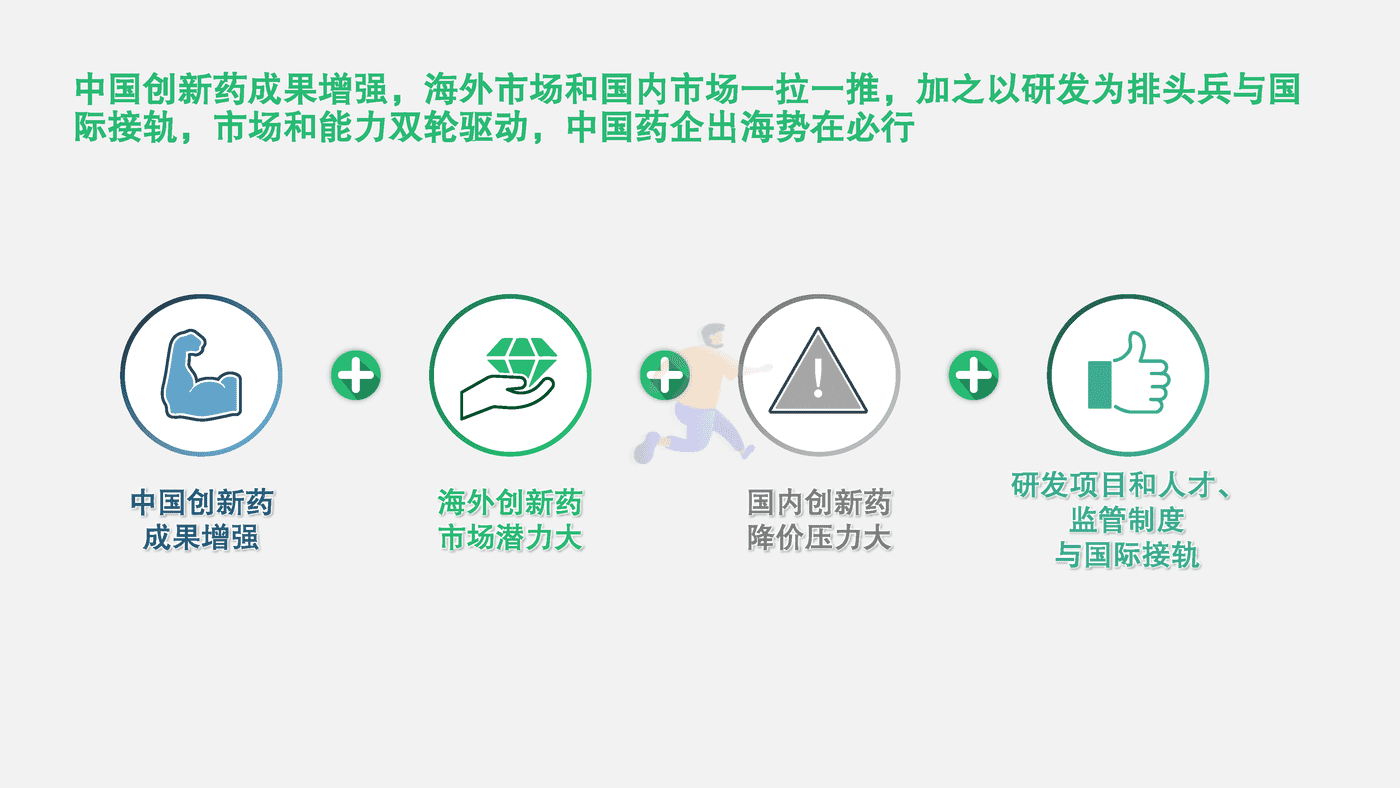
中国创新药成果增强,海外市场和国内市场一拉一推,加之以研发为排头兵与国际接轨,市场和能力双轮驱动,中国药企出海势在必行。
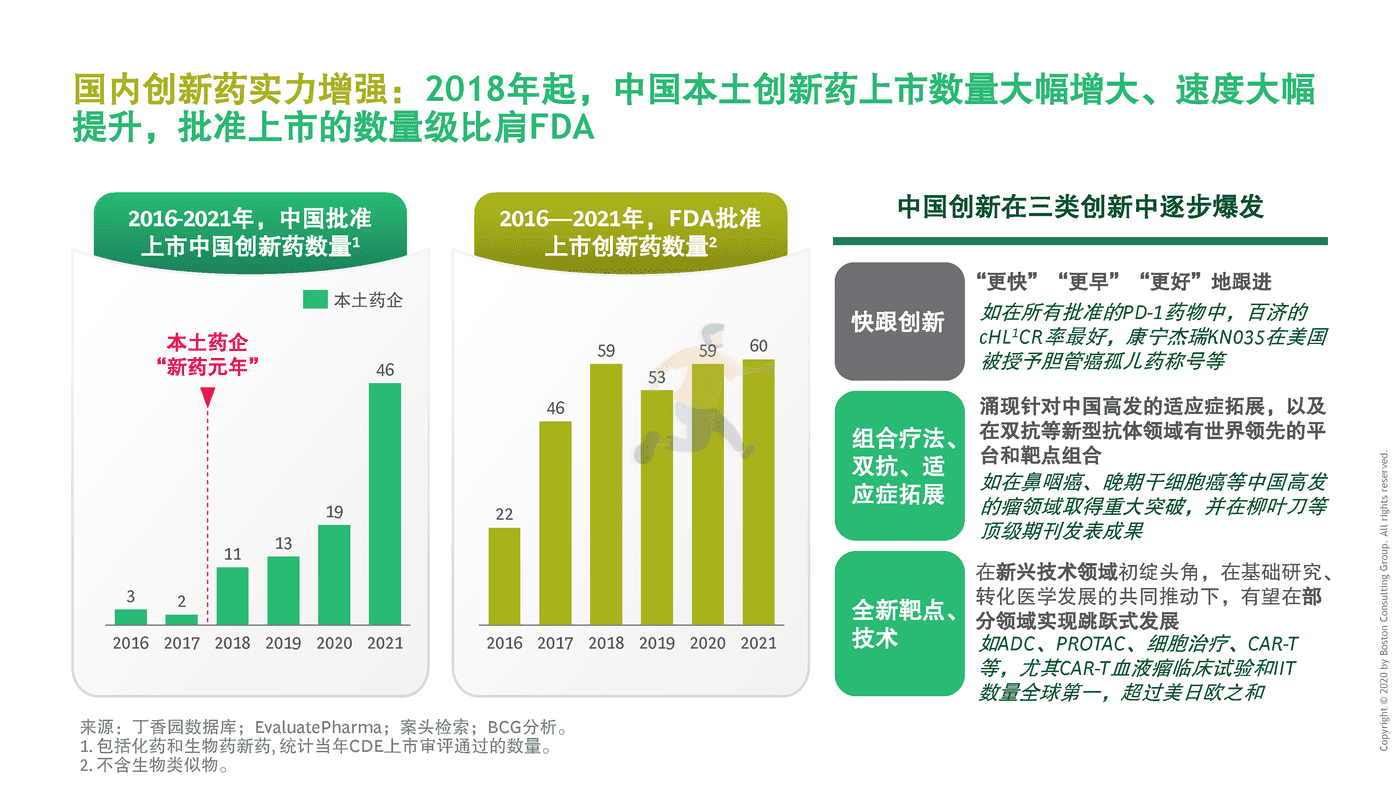
国内创新药实力增强:2018年起,中国本土创新药上市数量大幅增大、速度大幅提升,批准上市的数量级比肩FDA。






本文档共52页,请下载完整版阅读。
免责声明:本平台只做内容的收集及分享,内容版权归原撰写发布机构(或个人)所有,由小编通过公开合法渠道获得,如涉及侵权,请联系我们删除;如对报告内容存疑,请与撰写、发布机构联系。










